글리코사이드 결합
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
글리코사이드 결합은 당 분자가 다른 분자와 결합하여 형성되는 공유 결합으로, 결합에 참여하는 원자에 따라 O-글리코사이드, S-글리코사이드, N-글리코사이드, C-글리코사이드 결합으로 분류된다. 글리코사이드 결합은 단당류가 결합하여 이당류 및 다당류를 형성하는 데 중요한 역할을 하며, 생체 분자의 변형 및 기능 조절, 약물의 수용성 증가, O-결합 글리코펩타이드의 중추신경계(CNS) 투과성 향상 등 생물학적, 의약학적 측면에서 중요한 의미를 지닌다. DNA 분자 내에서 N-글리코사이드 결합은 염기와 디옥시리보스를 연결하며, DNA 손상 및 복구 과정에도 관여한다.
더 읽어볼만한 페이지
- 글리코사이드 - 사포닌
사포닌은 다양한 식물에서 발견되는 배당체의 일종으로, 계면활성제, 백신 보조제 등으로 사용되며 세포막 파괴 및 용혈 작용으로 독성을 나타낼 수 있는 물질이다. - 글리코사이드 - 말티톨
말티톨은 설탕 대체재로 사용되는 이당류 감미료로, 칼로리가 낮고 충치를 유발하지 않으며, 다양한 식품 및 제약 산업에서 활용되지만 과량 섭취 시 설사를 유발할 수 있다. - 탄수화물 화학 - 당단백질
당단백질은 탄수화물이 단백질에 공유결합된 복합체로, 다양한 형태로 존재하며 세포의 생물학적 과정에서 구조 유지, 물질 수송, 면역 반응, 세포 부착 및 인식 등 다양한 기능을 수행하는 생체 분자이다. - 탄수화물 화학 - 당화
당화는 아밀라아제 효소나 산을 이용하여 다당류인 전분을 단당류 또는 이당류로 분해하는 과정으로, 전통적인 방법으로는 누룩이나 맥아를 사용하여 일본주, 소주, 맥주, 위스키, 엿, 감주 등 다양한 식품 및 주류 제조에 활용된다. - 탄수화물 - 단당류
단당류는 (CH₂O)ₓ 화학식을 가지는 더 이상 가수분해되지 않는 가장 기본적인 형태의 탄수화물로, 탄소 원자 수에 따라 분류되고 알데히드기 또는 케톤기를 가지며, 수용액 상태에서 고리형 구조를 형성하는 경향이 있고, 포도당, 리보스, 데옥시리보스 등이 대표적인 예이다. - 탄수화물 - 소당류
소당류는 2~10개의 단당류로 구성된 탄수화물로, 당단백질 및 당지질 형성에 중요하며 세포 인식, 혈액형 결정, 세포 부착 등의 생리적 기능과 모유 올리고당과 같은 기능성 물질로 활용된다.
2. 글리코사이드 결합의 종류
글리코사이드 결합은 당의 아노머 탄소와 결합하는 원자의 종류, 그리고 결합의 입체화학적 특성에 따라 분류된다.
글리코사이드 결합은 글리코사이드를 아글리콘 또는 환원 말단의 당과 연결시키는 원자에 따라 O-, S-, N-, C-글리코사이드 결합으로 나뉜다. O-글리코사이드 결합은 산소 원자를 통해, S-글리코사이드 결합은 황 원자를 통해, N-글리코사이드 결합은 질소 원자를 통해, C-글리코사이드 결합은 탄소 원자를 통해 연결된다. 이 중 C-글리코사이드 결합은 국제순수·응용화학연합(IUPAC)에서 잘못된 명칭으로 간주한다.[1] 이러한 변형된 글리코사이드 결합은 가수분해에 대한 감수성이 다르며, C-글리코실 구조는 일반적으로 가수분해에 대한 내성이 더 강하다.
또한, 글리코사이드 결합은 아노머 탄소의 입체화학적 특성에 따라 α-글리코사이드 결합과 β-글리코사이드 결합으로 나뉜다.
2. 1. S-, N-, C-, 및 O-글리코사이드 결합
글리코사이드 결합은 결합에 참여하는 원자에 따라 다음과 같이 분류된다.- O-글리코사이드 결합: 글리코사이드가 아글리콘 또는 환원성 말단 당에 연결되는 글리코사이드 산소를 지칭한다.
- S-글리코사이드 결합: 글리코사이드 결합의 산소가 황으로 치환된 것이다. 티오글리코사이드를 형성한다.
- N-글리코사이드 결합: 글리코사이드 결합의 산소가 질소로 치환된 것이다. 글리코실아민이라고도 한다. RNA의 구성 성분인 아데노신은 아데닌과 리보스가 N-글리코사이드 결합을 통해 결합되어 있다.[16]
- C-글리코사이드 결합: 글리코사이드 결합의 산소가 탄소로 치환된 것이다. IUPAC에 의해 잘못된 명칭으로 간주되고 있다.[16]

이러한 글리코사이드 결합들은 가수분해에 대한 감수성이 다르며, C-글리코실 구조는 일반적으로 가수분해에 대한 내성이 더 강하다.[1]
2. 2. α- 및 β-글리코사이드 결합
아노머 위치의 상대적인 입체화학(R 또는 S)과 탄수화물의 1번 탄소(C-1)에서 가장 멀리 떨어져 있는 입체중심을 기반으로 α- 및 β-글리코사이드 결합을 구분한다.[17] α-글리코사이드 결합은 두 탄소가 동일한 입체화학을 가지고 있을 때 형성되는 반면, β-글리코사이드 결합은 두 탄소가 서로 다른 입체화학을 가지고 있을 때 형성된다.원래 α-와 β-입체구조는 하워스 투영식에서 주요 구성 성분들의 상대적인 방향성에 근거하여 정의되었다. D-당의 경우, β-입체구조는 고리의 평면 위에 그려진 각 탄소 주변의 주요 구성 성분을 볼 수 있지만(일반적으로 동일한 입체화학), α-입체구조는 고리 평면 아래에 그려진 아노머 탄소의 구성 성분(일반적으로 반대의 입체 구조)를 볼 수 있다. L-당의 경우에는 D-당의 경우와 반대가 된다. 이러한 오래된 정의는 과학 문헌에 남아 혼란을 초래할 수 있기 때문에 주목할 가치가 있다.[2]
일반적으로 글리코사이드 결합은 α-글리코사이드 결합과 β-글리코사이드 결합으로 구분되며, 1, 4, 6과 같은 숫자는 글리코사이드 결합을 하고 있는 탄소를 식별한다.
; α-글리코사이드 결합
: 당 구조의 평면보다 아래(액시얼) 방향으로 치환기가 결합한다.
; β-글리코사이드 결합
: 당 구조의 평면보다 위(에콰토리얼) 방향으로 결합한다.
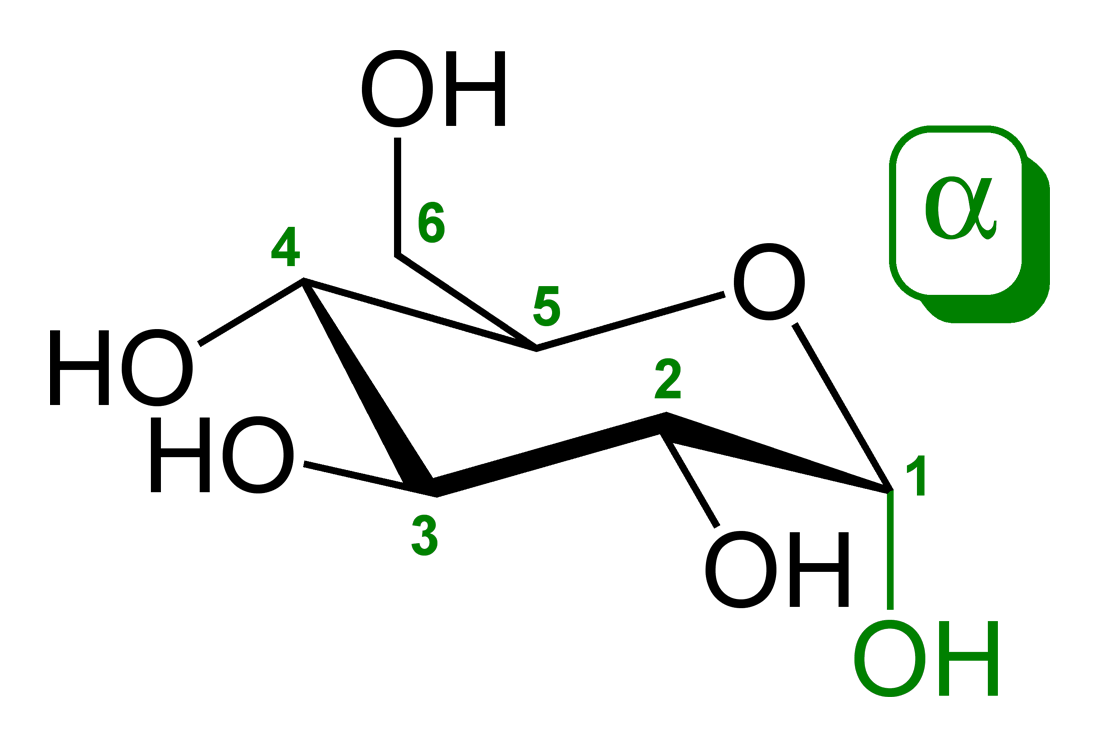
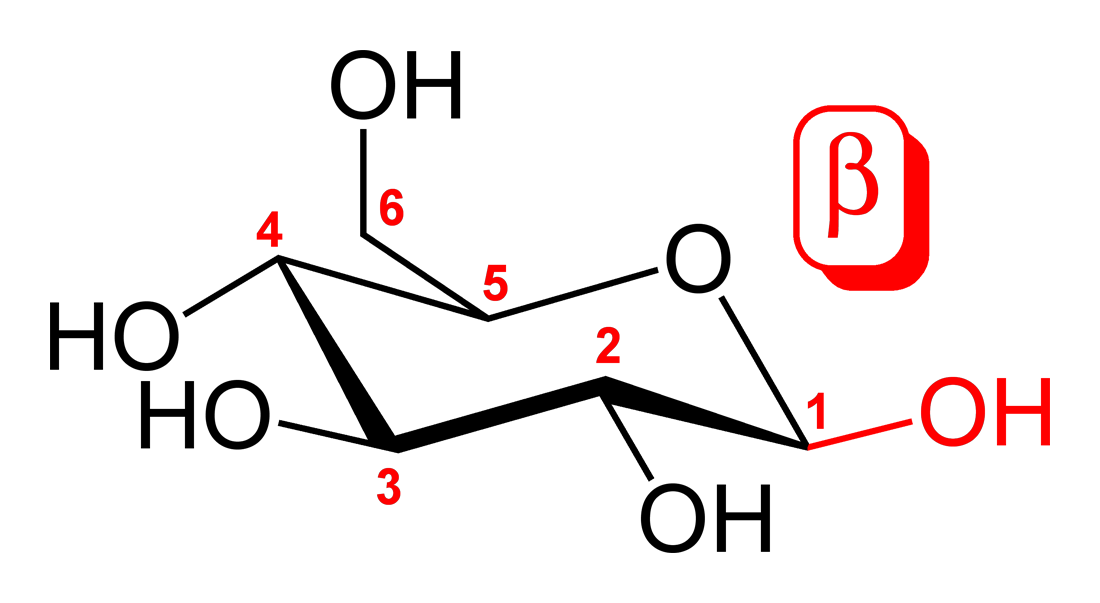

2. 3. 1,4- 및 1,6-글리코사이드 결합
탄수화물의 아노메릭 탄소를 포함하는 헤미아세탈은 반응성이 커서 산이 존재하면 쉽게 글리코사이드 결합을 형성한다. 이는 물 분자 하나를 방출하는 축합 반응이며, 글리코사이드 결합은 비교적 안정적이다.두 분자의 당이 글리코사이드 결합을 하면 이당류가 만들어진다. 예를 들어 갈락토스와 글루코스가 β-1,4-글리코사이드 결합을 하면 락토스가 형성된다. 더 많은 단당류들이 글리코사이드 결합을 통해 전분, 글리코겐, 셀룰로스, 키틴과 같은 다당류를 형성할 수 있다.
3. 글리코사이드 결합의 형성
글리코사이드 결합은 화학 반응 또는 효소의 촉매 작용을 통해 형성될 수 있다. 탄수화물의 헤미아세탈은 반응성이 커서 산이 존재하면 쉽게 글리코사이드 결합을 형성한다. 이는 1분자의 물을 방출하는 축합 반응이며, 생성된 글리코사이드 결합은 비교적 안정적이다.
글리코사이드 결합에서 산소 원자는 다른 원자로 치환될 수 있다. 예를 들어 산소가 황으로 치환되면 S-글리코사이드 결합, 질소로 치환되면 N-글리코사이드 결합, 탄소로 치환되면 C-글리코사이드 결합이라고 한다. N-글리코사이드 결합을 포함하는 물질은 글리코실아민이라고도 한다. IUPAC는 C-글리코사이드라는 용어를 잘못된 명칭으로 간주한다.[16] 이렇게 변형된 글리코사이드 결합은 가수분해에 대한 감수성이 다르며, C-글리코실 구조는 일반적으로 가수분해에 대한 내성이 더 강하다.
수용액에서 단당류는 사슬형 구조와 고리형 구조로 존재하며, 이들은 쉽게 상호 변환한다. 글리코사이드 결합을 만들 수 있는 것은 고리형 구조이며, 글리코사이드 결합이 형성되면 당은 사슬형 구조를 취할 수 없게 된다.
생물체 내에서 글리코사이드 결합은 글리코실트랜스퍼레이스 효소에 의해 합성된다. 단당류 단위체가 당단백질, 다당류 또는 지질에 통합되기 전에, 이들은 일반적으로 유리딘 이인산(UDP), 구아노신 이인산(GDP), 디옥시티미딘 이인산(dTDP), 사이티딘 일인산(CMP)과 같은 뉴클레오타이드의 인산기에 글리코사이드 결합을 통해 결합함으로써 먼저 "활성화"된다. 이렇게 활성화된 생화학 중간생성물들은 당뉴클레오타이드 또는 당 공여체라고 알려져 있다. 많은 생합성 경로들은 돌리콜과 같은 지질에 이인산 결합으로 활성화된 단당류 또는 올리고당류를 사용한다. 이들 활성화된 공여체는 글리코실트랜스퍼레이스로 알려진 효소에 대한 기질이며, 글리코실트랜스퍼레이스는 활성화된 공여체로부터 수용체 기질(친핵체)로 당 단위체를 전달한다.[9]
3. 1. 화학적 합성
α- 및 β-글리코사이드 결합의 선택성을 촉진하기 위한 여러 가지 화학적 접근법이 존재한다. 피라노사이드의 선택성 및 전체적인 활성에 대한 높은 기질 특이성은 주요 합성에 어려움을 줄 수 있다. 글리코실화의 전체적인 특이성은 전형적인 글리코실화 동안 아노머 탄소가 겪을 수 있는 상대적인 전이 상태를 고려한 접근법을 이용함으로써 개선될 수 있다. 가장 주목할만한 것은 전이 상태에서 이러한 유형의 입체구조적인 조절을 수행할 수 있다면, 펠킨-안 에이젠슈타인(Felkin-Ahn-Eisenstein) 모델을 이론적 화학 설계로 인정하고 통합하는 것은 일반적으로 신뢰할 수 있는 결과를 제공할 수 있다는 것이다.[3][4][5]뉘흐터 등(2001)은 피셔 글리코사이드화에 대한 새로운 접근 방식을 제시했다. 마이크로파 오븐에 환류 장치를 갖춘 로터 반응기 및 압력 반응기를 사용하여, 뉘흐터 등(2001)은 α- 및 β-D-글루코사이드의 100% 수율을 달성할 수 있었다. 이 방법은 수 킬로그램 규모로 수행할 수 있다.
Joshi 등(2006)은 글리코실화 반응을 통해 알킬 D-글루코피라노사이드의 입체 선택적 합성을 위한 Koenigs-Knorr 반응을 제안했는데, 이는 은 또는 수은 염을 사용하는 기존 방법보다 저렴하고 독성이 적은 탄산 리튬을 사용한다는 점이 특징이다.[6] D-글루코스는 먼저 아세트산 무수물을 아세트산에 첨가하여 과아세테이트를 형성하여 보호한 다음, 브로민화 수소를 첨가하여 5-위치에서 브로민화 반응을 일으킨다. 알코올 ROH와 탄산 리튬을 첨가하면 OR기가 브로민을 대체하고, 아세틸화된 수산기를 보호 해제하면 비교적 높은 순도로 생성물이 합성된다. Joshi 등(2001)은 리튬이 5-위치의 탄소를 공격하는 친핵체로 작용하고, 전이 상태를 거쳐 알코올이 브로민 그룹을 대체한다고 제안했다. 이 방법의 장점은 입체 선택성과 리튬 염의 저렴함뿐만 아니라, 실온에서 반응이 가능하다는 점과 수율이 기존 Koenigs-Knorr 방법과 비교하여 비교적 우수하다는 점을 포함한다.[7]
플루오린 지향적 글리코실화는 B 선택성 및 탄수화물에 비자연적인 생체 모방 C2 기능의 도입 모두에 대해 유망한 손잡이를 나타낸다. Bucher 등이 제공한 한 가지 혁신적인 예는 플루오로 옥소늄 이온과 트리클로로아세트이미데이트를 활용하여 고쉬 효과를 통해 B 입체 선택성을 높이는 방법을 제공한다.[11] 이러한 합리적인 입체 선택성은 가능한 의자 형태의 Felkin-Ahn 모델을 시각화하여 명확하게 확인할 수 있다.
이 방법은 전형적인 트리클로로아세트이미데이트 화학을 사용하여 B-에틸, 이소프로필 및 기타 글리코사이드를 선택적으로 통합하는 유망한 방법을 제시한다.
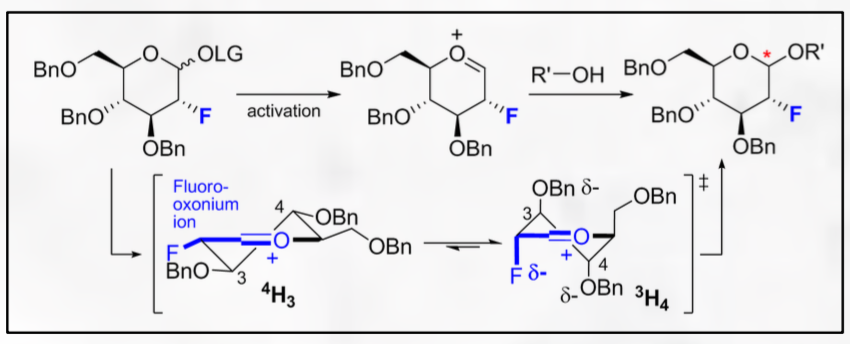
3. 2. 효소적 합성 (생체 내 합성)
단당류 단위체가 살아있는 생물체의 당단백질, 다당류 또는 지질에 통합되기 전에, 이들은 일반적으로 유리딘 이인산(UDP), 구아노신 이인산(GDP), 디옥시티미딘 이인산(dTDP), 사이티딘 일인산(CMP)과 같은 뉴클레오타이드의 인산기에 글리코사이드 결합을 통해 결합함으로써 먼저 "활성화"된다. 이렇게 활성화된 생화학 중간생성물들은 당뉴클레오타이드 또는 당 공여체라고 알려져 있다. 많은 생합성 경로들은 돌리콜과 같은 지질에 이인산 결합으로 활성화된 단당류 또는 올리고당류를 사용한다. 이들 활성화된 공여체는 글리코실트랜스퍼레이스로 알려진 효소에 대한 기질이며, 글리코실트랜스퍼레이스는 활성화된 공여체로부터 수용체 기질(친핵체)로 당 단위체를 전달한다.[9]4. 글리코사이드 결합의 분해
글리코사이드 가수분해효소(글리코시데이스)는 글리코사이드 결합을 분해하는 효소이다. 글리코사이드 가수분해효소는 전형적으로 α-글리코사이드 결합 또는 β-글리코사이드 결합에 작용할 수 있지만, 둘 다에 작용하지는 않는다.[18]
4. 1. 글리코사이드 가수분해효소 (글리코시데이스)
글리코사이드 가수분해효소(글리코시데이스)는 글리코사이드 결합을 가수분해하는 효소이다.[18] 글리코사이드 가수분해효소는 전형적으로 α-글리코사이드 결합 또는 β-글리코사이드 결합에 작용할 수 있지만, 둘 다에 작용하지는 않는다. 이러한 특이성으로 인해 연구자들은 높은 에피머 초과량의 글리코사이드를 얻을 수 있는데, 한 예로 글루코사이드 가수분해효소를 이용해서 D-글루코스를 에틸 β-D-글루코피라노사이드로 전환한 것이 있다. 글루코사이드 가수분해효소를 효소의 생물학적 기능과는 정반대로 사용했다는 점은 주목할 필요가 있다.[18]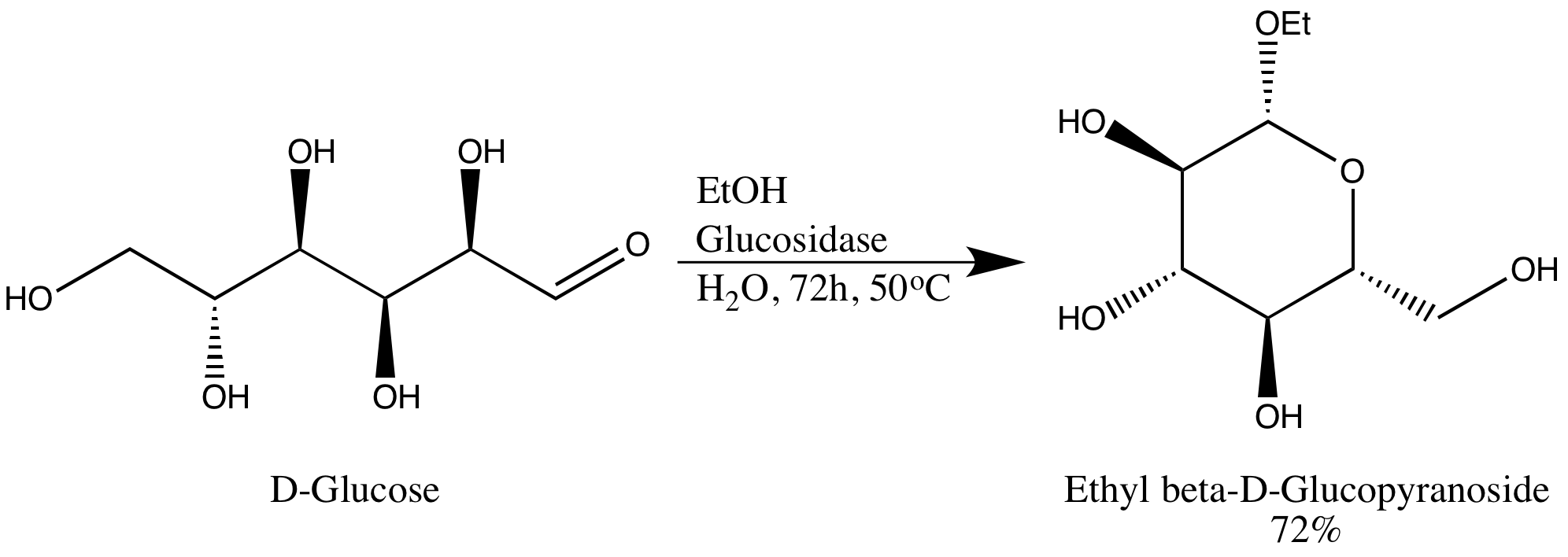
4. 2. 이당류 포스포릴레이스
글리코사이드 가수분해효소(글리코시데이스) 외에 글리코사이드 결합을 분해하는 또 다른 효소로 이당류 포스포릴레이스가 있다. 이 효소는 특정 조건에서 글리코사이드 합성에 사용될 수도 있다. 드 윈터(De Winter) 등은 이온성 액체에서 알파-글리코사이드 합성을 위한 셀로비오스 포스포릴레이스의 사용을 연구했다. 이 연구에서 셀로비오스 포스포릴레이스를 사용하기 위한 최상의 조건은 IL AMMOENG 101과 아세트산 에틸이 존재하는 조건인 것으로 밝혀졌다.[10]5. 글리코사이드 결합의 생물학적 중요성
글리코사이드 결합은 비교적 안정적인 결합으로, 두 분자의 당을 연결하여 이당류를 형성한다. 예를 들어 갈락토스와 글루코스가 β-1,4-글리코사이드 결합을 하면 락토스가 만들어진다. 더 많은 단당류들이 글리코사이드 결합을 통해 전분, 글리코겐, 셀룰로스, 키틴과 같은 다당류를 형성할 수 있다. 단당류의 환상 구조는 견고하지만, 글리코사이드 결합은 다당류 분자가 접힐 수 있도록 유연성을 제공한다.[2]
글리코사이드 결합은 단백질, 지질 등 다양한 생체 분자에 당을 붙여(글리코실화) 생체 분자의 구조, 안정성, 기능 등을 조절한다.[17] 약학에서는 물질의 수용성을 높이기 위해 글리코사이드 결합을 이용하여 글루쿠론산을 물질에 첨가하기도 하는데, 이를 글루쿠론산화라고 한다.[9]
단당류가 살아있는 생물체의 당단백질, 다당류 또는 지질에 결합되기 전에는, 보통 유리딘 이인산(UDP), 구아노신 이인산(GDP), 디옥시티미딘 이인산(dTDP), 사이티딘 일인산(CMP)과 같은 뉴클레오타이드의 인산기에 글리코사이드 결합을 통해 먼저 "활성화"된다. 이러한 활성화된 중간생성물은 당뉴클레오타이드 또는 당 공여체라고 불린다. 많은 생합성 과정에서 돌리콜과 같은 지질에 이인산 결합으로 활성화된 단당류나 올리고당류가 사용된다. 활성화된 공여체는 글리코실트랜스퍼레이스 (글리코실전이효소)라는 효소의 기질이 되어, 활성화된 공여체로부터 수용체 기질(친핵체)로 당 단위체를 전달한다.
5. 1. 다당류의 구조 형성
글리코사이드 결합은 비교적 안정적인 결합이다. 두 분자의 당이 글리코사이드 결합을 하면 이당류를 형성한다. 예를 들어, 갈락토스와 글루코스가 β-1,4-글리코사이드 결합을 하여 락토스가 형성된다. 더 많은 단당류가 글리코사이드 결합을 하면 전분, 글리코겐, 셀룰로스, 키틴과 같은 다당류를 형성한다. 단당류의 환상 구조 단위는 견고하지만, 글리코사이드 결합은 다당류 분자에 유연성을 부여하여 접힐 수 있게 된다.[2]5. 2. 생체 분자의 변형 및 기능 조절
글리코사이드 결합은 단백질, 지질 등 다양한 생체 분자에 당을 부착(글리코실화)하여 생체 분자의 구조, 안정성, 기능 등을 조절한다.[17] 약리학자들은 물질의 수용성을 높이기 위해 글리코사이드 결합을 통해 글루쿠론산을 물질에 첨가하는데, 이것은 글루쿠론산화로 알려져 있다.[9]단당류 단위체가 살아있는 생물체의 당단백질, 다당류 또는 지질에 통합되기 전에는, 일반적으로 먼저 유리딘 이인산(UDP), 구아노신 이인산(GDP), 디옥시티미딘 이인산(dTDP), 사이티딘 일인산(CMP)과 같은 뉴클레오타이드의 인산기에 글리코사이드 결합을 통해 결합되어 "활성화"된다. 이렇게 활성화된 생화학 중간생성물들은 당뉴클레오타이드 또는 당 공여체로 알려져 있다. 많은 생합성 경로들은 돌리콜과 같은 지질에 이인산 결합으로 활성화된 단당류 또는 올리고당류를 사용한다. 이들 활성화된 공여체는 글리코실트랜스퍼레이스 (글리코실전이효소)로 알려진 효소에 대한 기질이며, 글리코실트랜스퍼레이스는 활성화된 공여체로부터 수용체 기질(친핵체)로 당 단위체를 전달한다.
6. 글리코사이드 결합의 의약학적 응용
O-결합 글리코펩타이드는 여러 질병 모델 동물에서 우수한 중추신경계(CNS) 투과성 및 효능을 보이는 것으로 나타났다. 또한 O-글리코실화는 활성 펩타이드의 약동학(PK) 및 약력학(PD)을 개선시키는 능력이 있다.[20][21][22][23]
6. 1. O-결합 글리코펩타이드
O-결합 글리코펩타이드는 여러 질병 모델 동물에서 우수한 중추신경계(CNS) 투과성 및 효능을 보이는 것으로 나타났다. 또한 O-글리코실화는 반감기를 늘리고, 클리어런스(clearance)를 감소시키며, CNS 침투를 증가시켜 활성 펩타이드의 약동학(PK)/약력학(PD)을 개선시키는 능력이 있다.[20][21][22][23] 2단계와 3단계 대사(글루쿠론산)에서 가용화 부분으로서 당을 활용하는 것은 포유류 효소가 보다 큰 부분의 O-글리코실화된 생성물을 분해하도록 직접적으로 진화하지 않았다는 점에서 진화상의 이점을 제공하였다.O-결합 글리코펩타이드가 CNS 침투제로 작용하는 예는 많다. 이러한 효과의 근본적인 이유는 "멤브레인 호핑(membrane hopping)" 또는 "홉 확산(hop diffusion)"을 포함하는 것으로 생각된다. 비브라운 운동에 의한 홉 확산 과정은 원형질막의 불연속성으로 인해 일어난다고 생각된다. 홉 확산은 특히 자유 확산과 상호 비교적 전환이 결합되어 있다. 최근의 예로는 다른 펩타이드들 중에서도 특히 메트엔케팔린(metenkephalin) 유사체의 높은 투과성이 있다. 또한 뮤-오피오이드 수용체(μ-opioid receptor)의 작용제인 DAMGO는 펜타펩타이드로 글리코실화되면 CNS 침투제가 된다.[12][13][14]
7. N-글리코사이드 결합과 DNA
DNA 분자는 아미노기를 포함하는 염기 및 두 개의 인산기와 직접 연결된 디옥시리보스라고 불리는 5원 탄소 고리를 포함한다. 뉴클레오티드의 아미노기에서 질소 원자는 N-글리코시드 결합을 통해 리보스 당 구조의 아노머 탄소에 공유 결합된다. 때때로, 리보스에 부착된 염기는 탈아미노화, 알킬화 또는 산화를 겪어 DNA 백본을 따라 세포 독성 병변을 초래한다. 이러한 변형은 DNA 분자의 응집력을 심각하게 위협하여 암과 같은 질병의 발병으로 이어진다.[15]
DNA 글리코실라아제는 2' 탄소에서 탄소-질소 글리코시드 결합을 절단하여 손상되거나 변형된 염기를 DNA로부터 유리시키기 위해 N-글리코시드 결합의 가수 분해를 촉매하는 효소이며, 이어서 염기 절제 복구 (BER) 경로를 시작한다.[15]
단일 기능 글리코실라아제는 단계적, SN1 유사 메커니즘 또는 협동적, SN2 유사 메커니즘을 통해 N-글리코시드 결합의 가수 분해를 촉매한다. 단계적 기능에서 염기는 아노머 탄소가 물 분자에 의해 공격받기 전에 이탈기로 작용하여 수명이 짧고 불안정한 옥사카르베늄 이온 중간체를 생성한다. 이 중간체는 근처의 물 분자와 빠르게 반응하여 리보스와 염기의 N-글리코시드 결합을 하이드록시기를 갖는 O-글리코시드 결합으로 치환한다. 협동적 메커니즘에서 물은 친핵체로 작용하고 염기가 이탈기로 작용하기 전에 아노머 탄소를 공격한다. 생성된 중간체는 하이드록시기와 염기가 모두 아노머 탄소에 여전히 부착된 유사한 옥사카르베늄 이온이다. 두 메커니즘 모두 이론적으로 동일한 생성물을 생성한다. 대부분의 리보뉴클레오티드는 협동적 SN2 유사 메커니즘을 통해 가수 분해되는 반면, 대부분의 데옥시리보뉴클레오티드는 단계적 유사 메커니즘을 통해 진행된다.[15]
이러한 반응은 실질적으로 비가역적이다. DNA 백본으로부터 N-글리코시드 결합의 절단이 유기체에서 해로운 돌연변이 유발 및 세포 독성 반응을 유발할 수 있다는 사실 때문에, 무염기 DNA 부위와 특정 염기를 통해 N-글리코시드 결합의 합성을 촉매하는 능력도 가지고 있다.[15]
참조
[1]
웹사이트
Nomenclature of Carbohydrates (Recommendations 1996)
http://www.sbcs.qmul[...]
[2]
서적
Essentials of Glycobiology
Cold Spring Harbor Laboratory Press
[3]
논문
Ueber die Glucoside der Alkohole
https://zenodo.org/r[...]
[4]
논문
Ueber die Verbindungen der Zucker mit den Alkoholen und Ketonen
https://zenodo.org/r[...]
[5]
논문
Microwave-Assisted Synthesis of Alkyl Glycosides
[6]
논문
A convenient stereoselective synthesis of β-D-glucopyranosides
[7]
논문
Ueber einige Derivate des Traubenzuckers und der Galactose
https://zenodo.org/r[...]
1901
[8]
서적
Practical Methods for Biocatalysis and Biotransformations
John Wiley & Sons
2009-12-09
[9]
논문
Fluorine-directed glycosylation
2010-11
[10]
논문
Chemoenzymatic Synthesis of β-D Glucosides using Cellobiose Phosphorylase from Clostridium thermocellum
[11]
논문
Fluorine-Directed β-Galactosylation: Chemical Glycosylation Development by Molecular Editing
https://chemistry-eu[...]
2022-04-24
[12]
논문
Improved bioavailability to the brain of glycosylated Met-enkephalin analogs
2000-10
[13]
논문
Glycosylated neuropeptides: a new vista for neuropsychopharmacology?
2005-09
[14]
논문
Biousian glycopeptides penetrate the blood–brain barrier
2005-01-10
[15]
논문
Mechanisms for enzymatic cleavage of the N-glycosidic bond in DNA
2014-11
[16]
웹인용
Nomenclature of Carbohydrates (Recommendations 1996)
http://www.sbcs.qmul[...]
[17]
서적
Essentials of Glycobiology. 2nd edition.
National Center for Biotechnology Information, U.S. National Library of Medicine
[18]
서적
Practical Methods for Biocatalysis and Biotransformations
John Wiley & Sons
2009-12-09
[19]
저널
Chemoenzymatic Synthesis of β-D Glucosides using Cellobiose Phosphorylase from Clostridium thermocellum
[20]
저널
Improved bioavailability to the brain of glycosylated Met-enkephalin analogs
http://www.sciencedi[...]
2000-10-20
[21]
저널
Glycosylated neuropeptides: a new vista for neuropsychopharmacology?
https://archive.org/[...]
2005-09-01
[22]
저널
Glycosylated neuropeptides: A new vista for neuropsychopharmacology?
2005-09-01
[23]
저널
Biousian glycopeptides penetrate the blood–brain barrier
http://www.sciencedi[...]
2005-01-10
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
